Dra. Rosana Bronberg Farmacéutica Especialista en Esterilización y bioquímica UBA
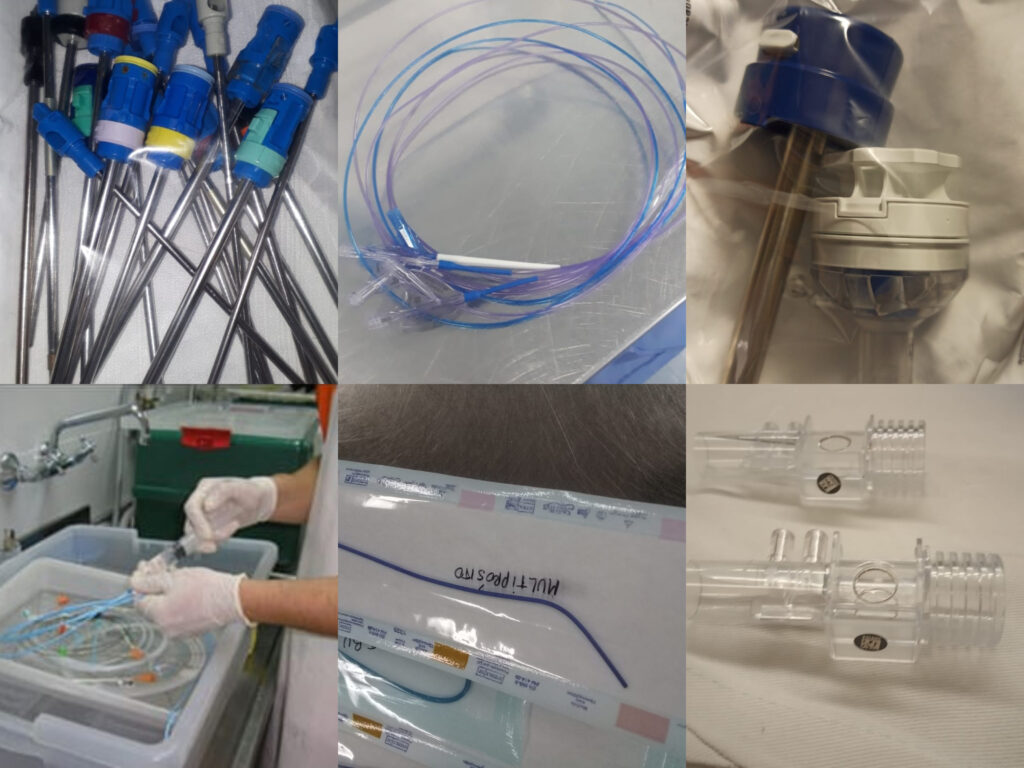
El reuso de productos médicos (PM) de un solo uso constituye un tema controversial. Debemos analizar las consideraciones éticas, el riesgo de los pacientes, el costo efectivo, la funcionalidad del PM, la legislación, la responsabilidad, la seguridad de los profesionales de la salud y el rol de las autoridades gubernamentales.
Si bien la preservación de la funcionalidad es uno de los más importantes aspectos relacionados con la decisión de reuso, hay estudios científicos detallados en la literatura que han investigado el deterioro de los materiales y de la función en PM descartables reusados y la posibilidad de formación de biopelículas (biofilms). El proceso de esterilización es uno de los factores que deben ser evaluados en los estudios de deterioro de los productos médicos ya que estos están generalmente manufacturados con polímeros o plásticos de densidad variable.
LOS PM DESCARTABLES REUTILIZADOS DEBEN CUMPLIR CON LOS MISMOS REQUISITOS O ESPECIFICACIONES QUE CUMPLEN LOS PRODUCTOS MEDICOS ORIGINALES.
ALGUNOS PAÍSES HAN IMPLEMENTADO LA LEGISLACIÓN QUE PROHÍBE ESTA PRÁCTICA, OTROS NO.
En la ARGENTINA existe la Resolución Ministerial 255/94. Quiero destacar que esta Resolución está desactualizada en los artículos que se mencionan a continuación. Varios de los PM del Anexo I son imposibles de limpiar y por lo tanto reusar. Además especifica que esos productos médicos se pueden reusar tres veces, pero no refiere la evidencia científica en la cual se basa y recomienda esta práctica.


Los productos médicos de un solo uso reutilizados deben cumplir con los mismos requisitos o especificaciones que cumplen los productos médicos originales. Además la Central de Esterilización debe estar habilitada para tal fin por la autoridad de aplicación. El ANMAT no habilita Centrales de Esterilización en los Hospitales e instituciones de Salud.
Los titulares y directores médicos serán responsables solidarios en cuanto a las acciones derivadas del reuso de productos médicos según esta Resolución ministerial.
Recomiendo antes de tomar decisiones estudiar la Resolución Ministerial en su totalidad, para poder tomar decisiones basadas en buenas prácticas y por sobre todo cuidar la seguridad de nuestros pacientes.


En EUROPA: REGLAMENTO (UE) 2017/745 DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 5 de abril de 2017 sobre los productos sanitarios, por el que se modifican la Directiva 2001/83/CE, el Reglamento (CE) Nº 178/2002 y el Reglamento (CE) Nº 1223/2009 y por el que se derogan las Directivas 90/385/CEE y 93/42/CEE
A más tardar el 27 de mayo de 2024, la Comisión elaborará un informe sobre la puesta en práctica del presente artículo y lo presentará al Parlamento Europeo y al Consejo.
Artículo 17
Productos de un solo uso y su reprocesamiento
- El reprocesamiento y la nueva utilización de productos de un solo uso podrán llevarse a cabo solo cuando lo permita la legislación nacional.
- Toda persona física o jurídica que reprocese un producto de un solo uso para hacerlo apto para una nueva utilización dentro de la Unión será considerada fabricante del producto reprocesado y asumirá las obligaciones que incumben a los fabricantes con arreglo al presente Reglamento, que incluyen las obligaciones relacionadas con la trazabilidad del producto reprocesado.
- Refiere a productos de un solo uso que se reprocesen y usen en un centro sanitario,
- La seguridad y el funcionamiento del producto reprocesado equivalgan a las del producto original.
Solo podrá efectuarse el reprocesamiento de productos de un solo uso que se considere seguro de acuerdo con los datos científicos más recientes.
En la ETIQUETA y en las instrucciones de uso del producto reprocesado se indicarán el nombre y la dirección de la persona física o jurídica a la que se refiere el apartado 2, así como las demás informaciones pertinentes mencionadas en la sección 23 del anexo I. El nombre y la dirección del fabricante del producto de un solo uso original dejarán de figurar en la etiqueta, aunque se indicarán en las instrucciones de uso del producto reprocesado.
Existe evidencia que la SEGURIDAD DEL PACIENTE se puede ver comprometida si se reutilizan PM de un solo uso por la imposibilidad de limpiar, descontaminar y esterilizar los mismos, así como las posibles fallas por el uso reiterado. El FARMACÉUTICO Especialista en Esterilización de la Central de Esterilización deberá liderar la política de reuso si fuera autorizada por la autoridad gubernamental, e impulsar la adquisición de PM REUSABLES, para no incrementar la cantidad de residuos y el costo del cuidado de la salud. No se puede negar lo que sucede en todas las Instituciones de salud, por ese motivo el farmacéutico debe intervenir en las decisiones ya que es el profesional capacitado para demostrar lo que sucede con los productos médicos y los estudios que se le deben hacer va los mismos como lo hace con los medicamentos.
Los productos médicos interactúan físicamente y químicamente como el medicamento. Es muy importante cumplir con la legislación, validar todos los procesos y llevar la trazabilidad de los mismos.
El fabricante es el dueño del producto médico y el que presento toda la evidencia científica para ser aprobado en el ANMAT en nuestro país. Si se decidiera un reuso de productos médicos de un solo uso, este debería ser autorizado por la autoridad gubernamental, siempre presentando EVIDENCIA CIENTIFICA, con los estudios de biocompatibilidad y todos los que presenta el fabricante para asegurar el reuso SEGURO de los mismos.
Por último me gustaría que reflexionemos sobre estos interrogantes.
¿EL PACIENTE SE ENCUENTRA INFORMADO SI UTILIZARAN CON ÉL UN PRODUCTO MÉDICO DE UN SOLO USO (DESCARTABLE) NUEVO O REUSADO, PUEDE ELEGIR?
¿EL PACIENTE SE ENCUENTRA INFORMADO DE LOS RIESGOS POR LA UTILIZACION DE PM REUSADOS?

La ética se relaciona con el estudio de la moral y de la acción humana. La ética, pues, estudia la moral y determina cómo deben actuar los miembros de una sociedad. Hay que legislar sobre este tema y hacer una tecno vigilancia interdisciplinaria con el objeto de identificar, evaluar y hacer seguimiento permanente de cualquier situación relacionada con un producto médico que puede llevar a un daño en un paciente.
